27 de junio de 2024
La Comisión Federal para la Protección contra Riesgos Sanitarios (Cofepris) emitió una alerta a médicos y a las instituciones de salud para que suspendan el uso de dos medicamentos fabricados por laboratorios de India. Uno está indicado para el manejo de enfermedad cardiaca y el otro para el tratamiento de leucemia linfoblástica aguda.
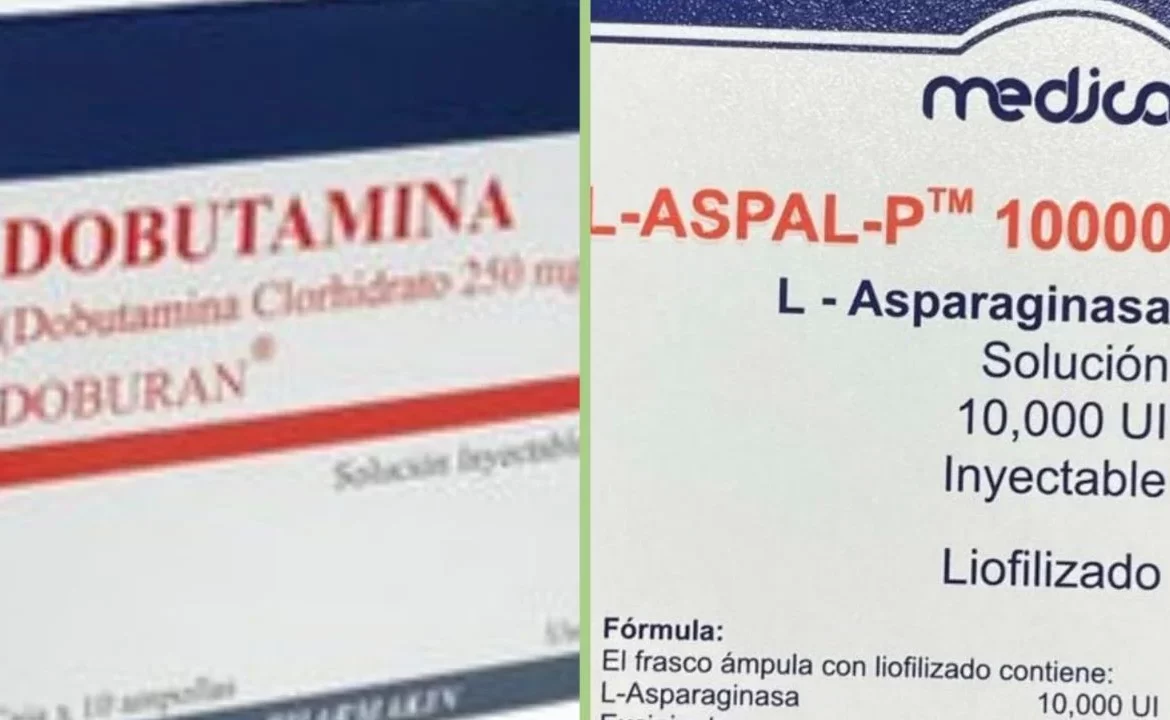
El primero es la Dobutamina que se utiliza para dar al corazón una mayor fuerza en el bombeo de la sangre. La agencia sanitaria indicó que en tres estados de la República se notificaron “irregularidades” sin dar mayores detalles.
El producto en solución inyectable intravenosa 250 mg/5mL es fabricado por Health Biotech Limited. La agencia sostuvo que la medida aplica para todos los lotes distribuidos por Biosistemas y Seguridad Privada, S.A. de C.V.
El segundo medicamento es L-ASPAL-P 10000 (L-asparaginasa) de 10 mil unidades internacionales (UI), solución inyectable, lote 22JLA01, con fecha de caducidad 09/2024. Es fabricado por SP Accure Lbas Pvt. Ltd e importado y distribuido en México por los laboratorios Vanquish SA de CV y Farmacéutico Médica SA de CV.
El uso de esta enzima está indicado para el manejo de la leucemia linfoblástica aguda.
La Cofepris indicó que ambos productos se deben inmovilizar de manera preventiva y mientras se realiza la investigación sanitaria.
El organismo también informó del inicio del trámite regulatorio para la fabricación en México, por primera vez, de biológicos y hemoderivados destinados a la atención de enfermedades de la sangre.
Indicó que una empresa nacional obtuvo la licencia sanitaria para la fabricación de estos medicamentos considerados esenciales, los cuales hasta ahora, se traen del extranjero.
La obtención de la licencia es el primer paso para iniciar la fabricación del producto biotecnológico en territorio nacional. En una siguiente etapa, el laboratorio deberá solicitar una visita por parte del personal de Cofepris para obtener el Certificado de Buenas Prácticas de Fabricación.
Una vez cumplidos estos requisitos, el fabricante deberá presentar la solicitud para la obtención de registro sanitario de cada medicamento. Los productos hematológicos se elaboran a partir de microorganismos, sangre u otros tejidos vivos. En su fabricación se pueden utilizar células y se extraen sustancias de tejidos biológicos de origen animal, vegetal y humano. La Cofepris indicó que las aplicaciones de estos fármacos son diversas, desde generar respuestas del sistema de defensas del organismo, hasta ayudar a pacientes con problemas de coagulación, así como en el tratamiento de enfermedades bacterianas.